 |
 |
Konfigurasi Elektron dan Tabel Periodik Unsur
Uraian
Pada materi kegiatan belajar 3 akan diuraikan tentang sifat-sifat periodik unsur. Sifat-sifat periodik unsur adalah sifat-sifat yang ada hubungannya dengan letak unsur pada sistem periodik. Sifat-sifat tersebut berubah dan berulang secara periodik sesuai dengan perubahan nomor atom dan konfigurasi elektron. Sifat periodik meliputi jari-jari atom, energi ionisasi, afinitas elektron dan keelektronegatifan.
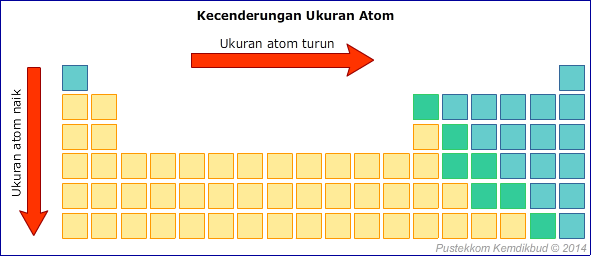
1. Jari-jari Atom
Jari-jari atom merupakan jarak elektron terluar ke inti atom dan menunjukkan ukuran suatu atom. Dalam suatu golongan, jari-jari atom semakin ke atas memiliki kecenderungan semakin kecil. Hal ini terjadi karena semakin ke atas, kulit elektron semakin kecil. Dalam suatu periode, semakin ke kanan jari-jari atom cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi elektron tetap sama sehingga tarikan inti terhadap elektron terluar semakin kuat.
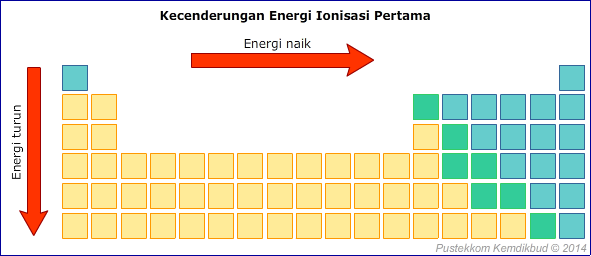
2. Energi Ionisasi
Energi yang diperlukan untuk melepaskan elektron dari suatu atom dinamakan energi ionisasi. Untuk unsur-unsur yang segolongan, energi ionisasi semakin ke bawah semakin kecil, karena elektron terluar semakin jauh dari inti (gaya tarik inti makin lemah), sehingga elektron terluar semakin mudah dilepaskan. Untuk unsur-unsur yang seperiode, energi ionisasi pada umumnya semakin ke kanan semakin besar, karena semakin ke kanan gaya tarik inti semakin kuat.
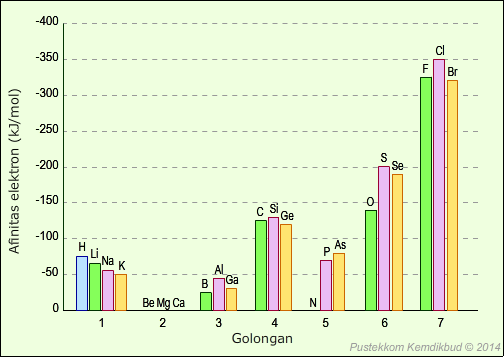
3. Afinitas Elektron
Afinitas elektron ialah energi yang dibebaskan atau yang diserap apabila suatu atom menerima elektron. Dalam satu periode dari kiri ke kanan, jari-jari semakin kecil dan gaya tarik inti terhadap elektron semakin besar, maka atom semakin mudah menarik elektron dari luar sehingga afinitas elektron semakin besar. Pada satu golongan dari atas ke bawah, jari-jari atom semakin besar, sehingga gaya tarik inti terhadap elektron semakin kecil, maka atom semakin sulit menarik elektron dari luar, sehingga afinitas elektron semakin kecil.
4. Keelektronegatifan
Kelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dari atom lain. Unsur-unsur yang segolongan : keelektronegatifan semakin ke bawah semakin kecil, karena gaya tarik-menarik inti makin lemah. Unsur-unsur yang seperiode : keelektronegatifan semakin ke kanan semakin besar. Keelektronegatifan terbesar pada setiap periode dimiliki oleh golongan VII A (unsur-unsur halogen).

![]()